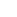Liên hệ tuyển sinh
Hợp tác Quốc tế
PROBENECID ỨC CHẾ SAO CHÉP SAR- COV-2 TRONG INVIVO VÀ INVITRO
Jackelyn Murray1, Robert J. Hogan1 , David E. Martin2 , Kathy Blahunka2 , Fred D. Sancilio4 , Rajiv Balyan3 , Mark Lovern3 , Richard Still2 & RalphA.Tripp1,2
Hiệu quả của các văc-xin đang làm chậm đại dịch COVID-19, nhưng SARS-CoV-2 có thể sẽ vẫn là một vấn đề trong tương lai, điều quan trọng là phải có phương pháp trị liệu để điều trị cho bệnh nhân. Có một số ít lựa chọn cho điều trị bệnh nhân bằng COVID-19. Chúng tôi cho thấy probenecid ngăn chặn mạnh mẽ sự sao chép của SARS-CoV-2 trong tế bào động vật có vú và sự nhân lên của vi rút trong mô hình chuột Hamster. Hơn nữa, chúng tôi chứng minh rằng nồng độ trong huyết thanh cao hơn tới 50 lần so với giá trị IC90 đã điều chỉnh gắn kết với protein trong 24 giờ sau một liều uống duy nhất. Những dữ liệu này hỗ trợ lợi ích lâm sàng về tiềm năng của probenecid để kiểm soát nhiễm SARS-CoV-2 ở người.
Hội chứng hô hấp cấp tính nghiêm trọng coronavirus 2 (SARS-CoV-2) gây ra bệnh coronavirus 2019 (COVID-19). Vào cuối năm 2019, thế giới biết rằng SARS-CoV-2 đã nổi lên như một đại dịch do Tổ chức Y tế Thế giới (WHO) công bố vào tháng 3 năm 2020. Tính đến cuối tháng 4 năm 2021, có > 141 triệu ca COVID-19 với > 3 triệu ca tử vong trên toàn thế giới theo Kho dữ liệu COVID-19 của Trung tâm Khoa học và Kỹ thuật Hệ thống (CSSE) tại Đại học Johns Hopkins. Đại dịch SARS-CoV-2 nhấn mạnh nhu cầu cấp thiết về liệu pháp điều trị hoặc phòng ngừa cấp bách hiện nay gồm 3 việc là các vắc-xin1-3, hỗ trợ giảm nhẹ và một loại thuốc kháng vi-rút, tức là remdesivir. Remdesivir là một chất tương tự nucleoside được FDA cấp phép sử dụng khẩn cấp (EUA) dựa trên việc chứng minh giảm thời gian hồi phục ở những bệnh nhân nhập viện vì COVID-19 nặng4. Việc sử dụng remdesivir bị hạn chế để điều trị bệnh nhân nội trú, các bệnh nhân COVID- 19 qua đường tiêm tĩnh mạch. Các loại Vắc xin và phương pháp điều trị phân tử nhỏ nhắm vào vi rút là các phương pháp tiếp cận chính của thuốc kháng vi-rút, nhưng các phương pháp tiếp cận bổ sung nhắm vào các gen tế bào ký chủ là cần thiết để giảm xu hướng phát triển kháng thuốc và vì con đường nhắm mục tiêu vào tế bào ký chủ có thể tạo ra hoạt tính kháng vi-rút phổ rộng5,6.
Việc xác định mục tiêu tế bào chủ quan trọng đối với sự nhân lên của vi rút được hỗ trợ bởi các phương pháp sàng lọc thông lượng cao (HTS) bao gồm việc sử dụng các phương pháp can thiệp RNA (RNAi)7. Cách tiếp cận này đã được sử dụng để xác định và xác nhận các phân tử đích và các con đường có các hoạt động kháng vi-rút chưa được đánh giá cao trước đây, đặc biệt là để tái sử dụng thuốc6,8. Việc sử dụng lại các loại thuốc hiện có với một hồ sơ lâm sàng đã biết có những lợi thế đáng kể so với việc phát hiện ra thuốc vì nó làm giảm rủi ro, thời gian và chi phí cho việc phát triển và đưa vào lâm sàng9. Sử dụng HTS để phát hiện ra các gen ký chủ cần thiết cho sự nhân lên của virus, gen vận chuyển anion hữu cơ 3 (OAT3) được xác định là gen ký chủ có thể được tái sử dụng như một ứng cử viên điều trị10.
OAT3 được tiết ra ở thận, đám rối màng mạch, giường mạch máu và các cơ quan ngoại vi khác bao gồm phổi11 và các chất trung gian vận chuyển qua màng của các anion hữu cơ nội sinh bao gồm urat và các chất khác và một số kháng sinh nhất định12. Probenecid {4 [(dipropyl-amino) sulfonyl] axit benzoic} là một chất điều trị thường được sử dụng để ức chế OAT313. Probenecid là một phương pháp điều trị bệnh gút và là một ứng cử viên thuận lợi cho việc thay thế thuốc kháng vi-rút, vì nó có sẵn trên thị trường với dược động học thuận lợi và có tính an toàn lành tính trên lâm sàng14. Dự phòng và điều trị bằng probenecid đã được chứng minh là làm giảm sự nhân lên của vi rút cúm trong ống nghiệm ở chuột10. Nồng độ ức chế nửa tối đa (IC50) để điều trị tế bào biểu mô hô hấp loại II A549 ở người (A549) bị nhiễm A/WSN/33 (H1N1) hoặc A/New Caledonia/20/99 (H1N1) tương ứng là 5 × 10-4 và 8 × 10-5 μM10.
Chúng tôi xác định IC50 cho tế bào Vero E6 và tế bào biểu mô phế quản (NHBE) của người bình thường được điều trị trước và tại thời điểm nhiễm SARS-CoV-2 và biến thể B.1.1.7. Kết quả cho thấy việc điều trị bằng probenecid đã ngăn chặn sự sao chép của SARS-CoV-2 (hình thành mảng bám) trong tế bào Vero E6 hoặc tế bào NHBE được điều trị với nồng độ probenecid khác nhau, tức là 0,00001–100 μM. Chúng tôi cũng đánh giá tải lượng vi rút phổi ở chuột hamster vào ngày 0, 3 và 7 pi với SARS-CoV-2 bằng cách sử dụng cả đo liều lây nhiễm nuôi cấy mô-50 (TCID50) và đo mảng bám vi rút để xác định số lượng đơn vị hình thành mảng bám (PFU). Chuột Hamster được điều trị bằng probenecid 24 giờ trước khi nhiễm bệnh (dự phòng), hoặc 48 giờ sau khi nhiễm bệnh (sau điều trị) với liều lượng 2 mg/kg và 200 mg/kg (Hình bổ sung 1). Hamster được điều trị bằng probenecid đã giảm đáng kể hiệu giá vi rút ở phổi, tức là giảm 4-5 log vi rút so với đối chứng, khoảng 109 log vi rút. Chúng tôi đã thực hiện một nghiên cứu mô hình và mô phỏng dược động học probenecid so sánh liều 600 mg hai lần mỗi ngày, 900 mg hai lần mỗi ngày hoặc 1800 mg một lần mỗi ngày. Mô hình dự đoán rằng nồng độ probenecid trong huyết tương sẽ vượt quá giá trị IC90 đã điều chỉnh gắn kết với protein tại mọi thời điểm trong suốt quá trình điều trị. Các liều được đánh giá bởi mô hình PK thấp hơn liều tối đa cho phép được FDA chấp thuận là 2 g/ngày và không được có tác dụng phụ đáng kể. Cùng với nhau, những dữ liệu này hỗ trợ mạnh mẽ tiềm năng của probenecid để cung cấp một phản ứng kháng vi-rút mạnh mẽ chống lại SARS-CoV-2.
Kết quả
Sau khi thực hiện sàng lọc RNAi trong tế bào biểu mô phổi loại II (A549) cho phép chúng tôi xác định và xác nhận các gen vật chủ cần thiết cho sự nhân lên của vi rút cúm6, chúng tôi đã chọn đánh giá OAT310. Sự lây nhiễm tế bào A549 với siRNA nhắm vào gen SLC22A8, OAT3, đã hoàn toàn ức chế sao chép vi rút cúm A/WSN/33 (H1N1) và điều trị bằng probenecid làm giảm nồng độ mRNA và protein OAT3 trong ống nghiệm và chuột BALB/c. Vì điều trị bằng probenecid trong ống nghiệm hoặc in vivo không ngăn chặn sự lây nhiễm vi rút cúm nhưng đã ngăn chặn hiệu giá vi rút được đo bằng xét nghiệm mảng bám và xét nghiệm ngưng kết máu, nên chúng tôi đã xác định được hiệu quả ức chế sao chép vi rút SARS-CoV-2 trong ống nghiệm trong tế bào Vero E6 và tế bào NHBE (Hình 1). Tế bào Vero E6 và tế bào NHBE đã được xử lý trước với nồng độ probenecid khác nhau và mức độ nhiễm trùng virion trong dịch nuôi cấy mô khác nhau được xác định sau 48 giờ nhiễm trùng bằng xét nghiệm mảng bám. Điều trị bằng probenecid làm giảm 90% sự sao chép của SARS-CoV-2 trong tế bào NHBE (A) hoặc 60% trong tế bào Vero E6 (B). Giá trị IC50 đối với probenecid được thể hiện là 0,75 μM trong tế bào Vero E6 và 0,0013 μM trong tế bào NHBE. Khả năng tồn tại cũng được đánh giá qua các nồng độ khác nhau, chứng tỏ không có độc tính với tế bào ở nồng độ thuốc cao nhất (dữ liệu không được hiển thị). Điều trị bằng probenecid cũng có hiệu quả trong việc ức chế một biến thể SARS-CoV-2 cần quan tâm (VOC), tức là hCoV-19 / USA / CA_CDC_5574 / 2020, B.1.1.7 (Hình bổ sung 2). Biến thể này được phân lập từ mẫu ngoáy mũi vào ngày 29 tháng 12 năm 2020, và sắp xếp nó thành dòng B.1.1.7 (biến thể còn gọi là biến thể Anh). VOC này có thể làm tăng khả năng truyền bệnh16.
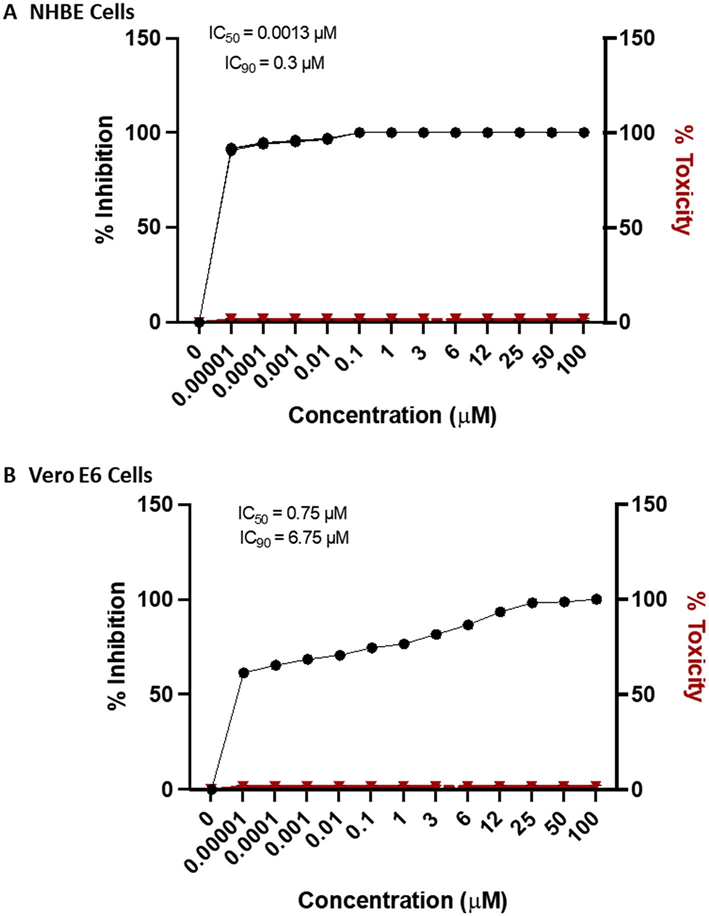
Sau khi cho thấy hiệu quả trong ống nghiệm và xác định các giá trị IC50, tiếp theo chúng tôi xác định hiệu quả của probenecid trong mô hình chuột Hamster được coi là mô hình tiền lâm sàng của bệnh SARS-CoV-2 với chuột Hamster bị viêm phổi tự giới hạn17,18. Chúng tôi đã kiểm tra chuột Hamster bị nhiễm SARS-CoV-2 và điều trị chúng bằng probenecid trong 24 giờ trước khi nhiễm bệnh (dự phòng) hoặc 48 giờ sau khi nhiễm bệnh (sau điều trị). Các nhóm dùng thuốc được kiểm tra là: a) hai nhóm dự phòng được điều trị với liều 2 mg/kg hoặc 200 mg/kg, b) hai nhóm sau điều trị được điều trị với liều 2 mg/kg hoặc 200 mg /kg, và hai nhóm đối chứng đã bị nhiễm hoặc không bị nhiễm SARS-CoV-2. Bệnh ở chuột Hamster sau khi nhiễm SARS-CoV-2 là thoáng qua đạt đỉnh điểm vào khoảng ngày thứ 3-4 sau khi nhiễm bệnh mà không có dấu hiệu lâm sàng17. Phù hợp với quan sát này, không có triệu chứng lâm sàng đáng kể hoặc sụt cân nào rõ ràng ở bất kỳ nhóm nào trong suốt nghiên cứu (Hình bổ sung 1). Hamster được điều trị bằng probenecid đã giảm đáng kể hiệu quả vi rút ở phổi (Hình 2), tức là giảm 4-5 log vi rút so với đối chứng PBS có khoảng 109 log vi rút. Vào ngày thứ 7, tất cả các nhóm đều loại bỏ vi rút trong phổi. Phân tích RT-qPCR cho thấy vi rút từ mức thấp đến không phát hiện ở ngày thứ 7 với Ct = 30 ngoại trừ điều trị 2 mg probenecid là Ct = 28 (Hình bổ sung 3).
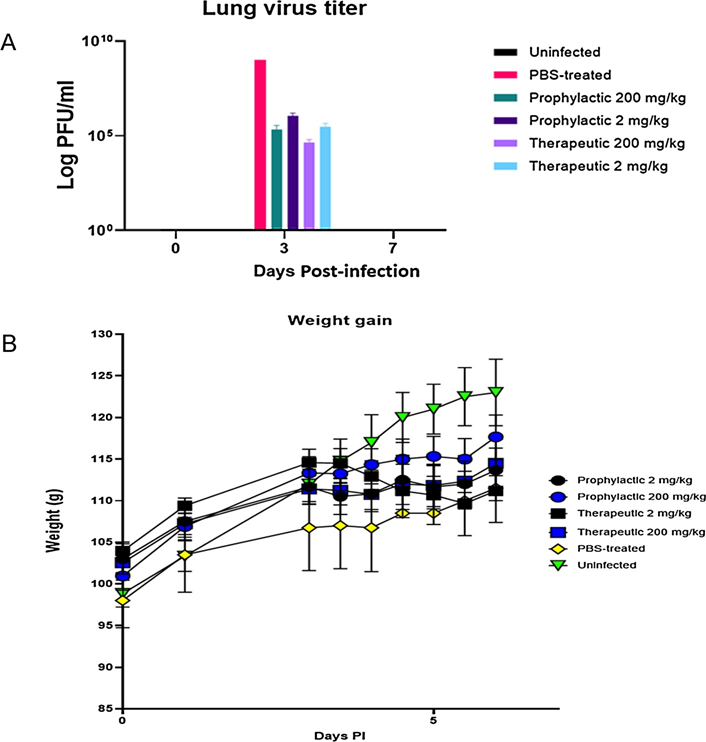
Cuối cùng, một mô hình dược động học quần thể (pop-PK) đã được phát triển để xác định đặc điểm PK của probenecid. Nó có cấu trúc một ngăn với khả năng khử bão hòa và hấp thụ bậc một. Chúng tôi đã thực hiện mô phỏng bằng cách sử dụng mô hình cuối cùng pop-PK để tạo ra các cấu hình phơi nhiễm probenecid so với liều 600 mg hai lần mỗi ngày, 900 mg hai lần mỗi ngày, hoặc 1800 mg một lần mỗi ngày (Hình 3 và Bảng 1). Việc kiểm tra các liều này được dự đoán là cung cấp nồng độ trong huyết tương vượt quá giá trị IC90 đã điều chỉnh gắn kết với protein tại mọi thời điểm. Tất cả các liều đều dưới liều tối đa cho phép được FDA chấp thuận và nói chung là an toàn mà không có tác dụng phụ đáng kể.
Thảo luận
Sự sẵn có của các phương pháp điều trị phân tử nhỏ đối với COVID-19 còn hạn chế. Hiện tại, chỉ có remdesivir đã nhận được sự chấp thuận của EUA để điều trị SARS-CoV-2 và nó phải được tiêm tĩnh mạch cho bệnh nhân nhập viện. Có một số thuốc kháng vi-rút bổ sung đang được phát triển để điều trị cho những bệnh nhân không nhập viện; tuy nhiên, họ đã không thể chứng minh sự phơi nhiễm thuốc lớn hơn đáng kể so với giá trị IC90 hiệu chỉnh gắn kết với protein19-21. Như thể hiện trong Bảng 1, tất cả các mức liều của probenecid được dự đoán sẽ vượt quá giá trị IC90 đã điều chỉnh gắn kết với protein từ 14 đến 44 lần. Điều quan trọng, probenecid có thì tính an toàn và lâu dài trong hơn 5 thập kỷ sử dụng. Với hiệu quả in vitro, khả năng lây nhiễm in vivo ở chuột Hamster, kết quả sơ bộ từ nghiên cứu khởi xướng của chúng tôi, và kết quả dược động học thuận lợi và mức độ an toàn lành tính, probenecid nên được coi là một lựa chọn điều trị tiềm năng cho bệnh nhân COVID-19.
Probenecid có tác dụng ức chế lây nhiễm trên virus RNA đặc biệt là infuenza10 và virus hợp bào hô hấp (RSV) (dữ liệu không được hiển thị). Probenecid làm tăng đào thải axit uric qua nước tiểu và đã được sử dụng một cách an toàn để điều trị bệnh gút và tăng axit uric máu22,23, đồng thời có tác dụng phụ tối thiểu nhưng có thể gây ra các triệu chứng nhẹ như buồn nôn, hoặc ăn mất ngon14. Probenecid có một số mục tiêu dược lý bao gồm ngăn chặn các pannexin làm cơ sở cho chức năng của kênh xuyên màng và giảm biểu hiện ACE226,27. Những ưu điểm chính của probenecid là nó là một loại thuốc điều trị được FDA chấp thuận đã có mặt trên thị trường hơn 50 năm, nó có thể được sử dụng bằng đường uống với dược động học thuận lợi, nó hoạt động ở cấp độ tế bào ký chủ, chịu được sự đột biến của virus, và có khả năng điều trị nhiều loại virus khác. Hơn nữa, dữ liệu của chúng tôi cho thấy rằng việc bắt đầu điều trị sau khi nhiễm trùng ở tế bào động vật có vú, chuột Hamster và người dẫn đến việc giảm sao chép SARS-CoV-2 một cách đáng kể, đặc biệt là trong cơ quan đích là phổi.
Điều trị bằng probenecid có thể sẽ có lợi trong việc ức chế các biến thể SARS-CoV-2 vì chúng tôi cho thấy rằng nó có hiệu quả chống lại VOC, chủng B.1.1.7. Điều này không nằm ngoài dự đoán, vì việc nhắm mục tiêu các quá trình ký chủ cần thiết cho sự nhân lên của virus như OAT3 sẽ được mong đợi là phổ biến. Trong số các mục tiêu ký chủ đã được xác định là mục tiêu tiềm năng để ức chế sự nhân lên của vi rút, phong tỏa OAT3 sẽ không gây ra bất kỳ cơ chế nào ảnh hưởng cho con người vì những người bị giảm chức năng OAT3 vẫn khỏe mạnh28 và sự phong tỏa về mặt dược lý đối với OAT3 được dung nạp một cách an toàn ở người29. Các hợp chất khác tương tác với OAT3 bao gồm thuốc kháng vi-rút oseltamivir phosphate (Tamifu) và acyclovir10, cũng như thuốc chẹn thụ thể angiotensin II30, tuy nhiên, tương tác của chúng yếu và các tác dụng dược lý của chúng gây ra các hạn chế về tính an toàn và dung nạp, ngăn cản việc sử dụng chúng trong việc tái sử dụng thuốc.
Hình 1. Probenecid ức chế mạnh sự sao chép của SARS-CoV-2 trong tế bào (A) NHBE và (B) tế bào Vero E6. Giá trị IC50 và IC90 được tính toán trong tế bào NHBE và tế bào Vero E6 sau khi điều trị với các nồng độ probenecid khác nhau. Độc tính tế bào được tính toán trong tế bào NHBE và tế bào Vero E6 sau khi điều trị với các nồng độ probenecid khác nhau và thực hiện xét nghiệm khả năng sống sót của tế bào để đo phần trăm độc tính dựa trên sự chuyển đổi thuốc nhuộm oxy hóa khử (resazurin) thành sản phẩm cuối huỳnh quang (resorufin) sau 72 giờ. Các số liệu được chuẩn bị bằng GraphPad Prism, v9.2, https://www.graphpad.com/updates/.
Phương pháp
An toàn sinh học. Các nghiên cứu về SARS-CoV-2 và các biến thể được thực hiện trong BSL3 đã được phê duyệt với các quy định về đạo đức có liên quan để thử nghiệm và nghiên cứu trên động vật. Nghiên cứu trên Hamster đã nhận được sự chấp thuận về đạo đức từ ủy ban IACUC của Đại học Georgia và được thực hiện bởi các nhân viên có chứng chỉ trong Hiệp hội Đánh giá và Công nhận Cơ sở chăm sóc động vật trong phòng thí nghiệm được Quốc tế công nhận. Công việc tuân theo các hướng dẫn của tổ chức về việc sử dụng động vật, các hướng dẫn và nguyên tắc cơ bản trong Hướng dẫn NIH về Chăm sóc và Sử dụng Động vật Phòng thí nghiệm, Đạo luật Phúc lợi Động vật, Bộ Nông nghiệp Hoa Kỳ và Chính sách Dịch vụ Y tế Công cộng Hoa Kỳ về Chăm sóc Nhân đạo và Sử dụng Động vật trong Phòng thí nghiệm.
.
Hình 2. (A) Hiệu giá vi rút phổi từ chuột hamster đực. Hamster được chia thành các nhóm trước nhiễm trùng hoặc sau nhiễm trùng và được điều trị bằng probenecid hoặc PBS (n = 6 / nhóm). Các nhóm nhận được 200 mg/kg hoặc 2 mg/kg probenecid dự phòng lúc trước khi nhiễm 24 giờ hoặc dự phòng ở 48 giờ sau khi nhiễm. Những chú chuột hamster đã bị nhiễm 103 PFU của SARS-CoV-2, và ở ngày thứ 3 hoặc 7 sau nhiễm trùng, phổi được thu hoạch và xác định mức độ vi rút bằng xét nghiệm mảng bám. (B) Tăng cân ở chuột Hamster được điều trị dự phòng hoặc điều trị với 200 mg/kg hoặc 2 mg/kg probenecid. Những con chuột Hamster không bị nhiễm bệnh hoặc những con chuột được điều trị PBS và bị nhiễm bệnh là đối chứng. Không thấy giảm cân đáng kể ở bất kỳ nhóm nào trong nghiên cứu này. Các số liệu được chuẩn bị bằng GraphPad Prism, v9.2, https://www.graphpad.com/updates/.
Các động vật. Những con chuột Hamster Syria đực được nhốt chung trong hệ thống lồng có mái che HEPA được làm giàu bằng vật liệu làm tổ và được cung cấp thương mại cùng nước và libitum. Số giao thức tế bào cho động vật cho nghiên cứu này là A2020 08-003-Y2-A3, "Nhiễm trùng Coronavirus trên mô hình hamster". Động vật được theo dõi ít nhất hai lần mỗi ngày trong suốt quá trình nghiên cứu. Hamster đã bị nhiễm 103 PFU SARS-CoV-2 trong mũi (USAWA1 / 2020; GenBank: MN985325.1). Hamster được điều trị bằng probenecid (Sigma, St. Louis, MO) 24 giờ trước khi nhiễm bệnh (dự phòng), hoặc 48 giờ pi (sau điều trị) với liều 2 mg/kg và 200 mg/kg. Tất cả các nhóm đều bị tử vong vào ngày thứ 3 hoặc ngày thứ 7, vì ngày thứ 3 đến ngày thứ 4 đã được báo cáo là cao điểm của sự nhân lên của vi rút31. Nghiên cứu được báo cáo phù hợp với các hướng dẫn ARRIVE.
Thiết kế nghiên cứu Hamster. Hamster được chia thành các nhóm trước hoặc sau nhiễm trùng và khi thích hợp được điều trị trong phúc mạc bằng probenecid (n = 6 /nhóm). Các nhóm được điều trị dự phòng với 200 mg/kg hoặc 2 mg/kg probenecid trước khi nhiễm bệnh 24 giờ, hoặc dự phòng sau 48 giờ sau khi nhiễm. Trọng lượng động vật được thu thập một lần mỗi ngày và động vật được theo dõi hai lần mỗi ngày để tìm các dấu hiệu và sự tiến triển của bệnh. Tất cả các thủ tục được thực hiện trên động vật được gây mê. Phổi được thu thập vào các ngày 0, 3 và 7 sau nhiễm bệnh để phân tích RT-qPCR.
Vi rút và các tế bào. SARS-CoV-2 phân lập nCoV-WA1-2020 (MN985325.1) hoặc biến thể (hCoV-19 / USA / CA_ CDC_5574 / 2020, B.1.1.7; GenBank: MW422255.1) đã được nhận từ Tài nguyên BEI được quản lý theo hợp đồng của American Type Culture Collection (ATCC). Vi rút được nhân giống trong tế bào Vero E6 và các tế bào được duy trì trong DMEM có hàm lượng glucose cao bổ sung 10% huyết thanh bò thai và 1 mM L-glutamine.
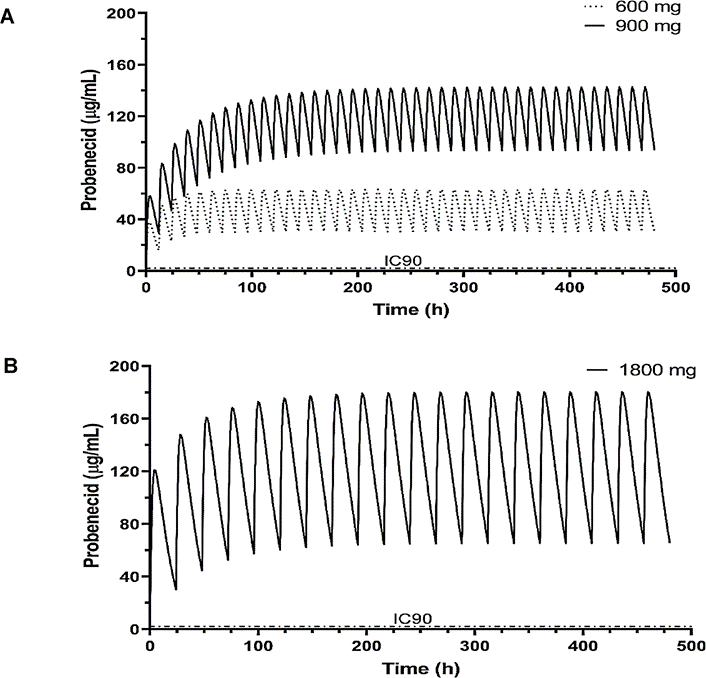
Hình 3. Nồng độ probenecid được mô phỏng. Một mô hình dược động học dân số đã được sử dụng để tạo ra hồ sơ phơi nhiễm probenecid so sánh (A) 600 mg hai lần mỗi ngày, 900 mg hai lần mỗi ngày hoặc (B) 1800 mg dùng một lần mỗi ngày trong 20 ngày. Mức IC90 được hiệu chỉnh cho 95% liên kết với protein là 2,08 µg/ml (được hiển thị dưới dạng đường đứt nét). Tất cả các liều cung cấp độ phơi nhiễm trên mức IC90 tại mọi thời điểm. Các số liệu được chuẩn bị bằng GraphPad Prism, v9.2, https://www.graphpad.com/updates/.
|
Dose (mg) |
Frequency |
Steady state concentration (μg/ml) |
Protein binding adjusted IC90 value (μg/mL) |
Ratio with IC90 |
|
600 |
BID |
30.1 |
2.08 |
14 |
|
900 |
BID |
92.5 |
2.08 |
44 |
|
1800 |
QD |
64.9 |
2.08 |
31 |
Bảng 1. Nồng độ ở trạng thái ổn định và tỷ lệ so với giá trị IC90 gắn với protein đã điều chỉnh sau các liều probenecid khác nhau.
Tải lượng vi rút bằng RT ‑ qPCR. RNA được chiết xuất từ phổi bằng bộ kit QIAamp Viral RNA (Qiagen) theo hướng dẫn của nhà sản xuất. Các mô đã được đồng nhất và chiết xuất RNA bằng bộ RNeasy (Qiagen) theo hướng dẫn của nhà sản xuất. Phân tích RT-qPCR của RNA tinh khiết được thực hiện bằng cách sử dụng xét nghiệm thăm dò CDC EUA N1 và xét nghiệm thăm dò kiểm soát nội bộ RNaseP của người CDC EUA để xác nhận việc chiết xuất RNA mẫu trong các phản ứng riêng biệt.
Chuẩn độ vi rút. Việc phân lập vi rút được thực hiện bằng cách cấy tế bào Vero E6 vào đĩa 96 giếng với loạt pha loãng 1:10 của vi rút, và một giờ sau khi cấy tế bào, chất cấy được loại bỏ và thay thế bằng 0,2 ml TCM. Sau 6 ngày cấy, tác nhân gây bệnh tế bào được tính điểm và TCID50 được tính bằng phương pháp Reed-Muench32.
Xét nghiệm SARS ‑ CoV ‑ 2 trong phòng thí nghiệm. Tế bào Vero E6 (ATCC CRL-1586) được mạ trong các đĩa 12 giếng ở 5 × 105 tế bào / giếng và ủ qua đêm ở 37 °C. Tế bào Vero E6 được rửa 1 lần bằng PBS và probenecid (Sigma) được thêm vào giếng trong môi trường DMEM và ủ ở 37 °C. Mỗi nồng độ thuốc được thử nghiệm ba lần và thí nghiệm lặp lại 9 lần một cách độc lập. Sau khi xử lý trước, môi trường DMEM được loại bỏ và các tế bào được bổ sung bằng TCM có chứa probenecid và SARS-CoV-2. Tế bào bị nhiễm ở 1 MOI = 0,01 trong 4 ngày. Các tế bào sau nhiễm trùng được pha trộn và nhuộm màu để hình dung các mảng. Phân tích thống kê bằng ANOVA một chiều với p < 0,05. Tế bào NHBE được lấy từ LONZA (Walkersville, MD) từ một bệnh nhân không hút thuốc. Các tế bào được gieo hạt ở 100.000 tế bào / bình T25 và được ủ ở 37 ° C. Khi các tế bào đạt 70–80% sự đồng nhất, chúng được phân ly bằng cách sử dụng trypsin và được mạ bằng cách sử dụng các điều kiện được mô tả ở trên để nuôi cấy với probenecid.
Mô hình hóa và mô phỏng. Dữ liệu về Probenecid PK được lấy từ một bản thảo đã xuất bản33. Trong nghiên cứu này, năm đối tượng nam giới trưởng thành khỏe mạnh (20–39 tuổi, 53–86 kg) được cho uống 500, 1000 và 2000 mg probenecid cách nhau ít nhất một tuần và máu được lấy cho đến 48 giờ. Những dữ liệu này phù hợp với hiệu ứng hỗn hợp phi tuyến tính sử dụng phần mềm Phoenix NLME34. Các ước lượng tham số cho mô hình PK33 với loại bỏ bão hòa (Michaelis– Menten) được sử dụng làm ước lượng ban đầu cho phân tích hiện tại. Mô hình được trang bị bằng cách sử dụng phương pháp ước lượng có điều kiện bậc nhất với thuật toán bình phương nhỏ nhất mở rộng (FOCE-ELS). Mô hình cơ sở thử nghiệm bao gồm cấu trúc một và hai ngăn cơ bản với khả năng hấp thụ bậc một. Các mô hình hấp thụ, thời gian trễ và thanh thải khác cũng được đánh giá. Một loạt các biểu đồ chẩn đoán đã được sử dụng để đánh giá mức độ phù hợp của mô hình PK. Mô hình popPK cuối cùng được sử dụng để mô phỏng phơi nhiễm do các chế độ dùng thuốc khác nhau được quan tâm về mặt lâm sàng (600 mg BID, 900 mg BID và 1800 mg QD).
Tài liệu tham khảo
1. Oliver, S. E. et al. Te advisory committee on immunization practices’ interim recommendation for use of moderna COVID-19 vaccine—United States, December 2020. MMWR Morb. Mortal. Wkly. Rep. 69, 1653–1656. https://doi.org/10.15585/mmwr.mm695 152e1 (2021).
2. Oliver, S. E. et al. Te advisory committee on immunization practices’ interim recommendation for use of Pfzer-BioNTech COVID-19 vaccine—United States, December 2020. MMWR Morb. Mortal. Wkly. Rep. 69, 1922–1924. https://doi.org/10.15585/ mmwr.mm6950e2 (2020).
3. Alturki, S. O. et al. Te 2020 pandemic: Current SARS-CoV-2 vaccine development. Front. Immunol. 11, 1880. https://doi.org/10. 3389/fmmu.2020.01880 (2020).
4. Ison, M. G., Wolfe, C. & Boucher, H. W. Emergency use authorization of remdesivir: Te need for a transparent distribution process. JAMA 323, 2365–2366. https://doi.org/10.1001/jama.2020.8863 (2020).
5. Hong-Geller, E. & Micheva-Viteva, S. N. Functional gene discovery using RNA interference-based genomic screens to combat pathogen infection. Curr. Drug Discov. Technol. 7, 86–94. https://doi.org/10.2174/157016310793180657 (2010).
6. Tripp, R. A. & Mark Tompkins, S. Antiviral efects of inhibiting host gene expression. Curr. Top. Microbiol. Immunol. 386, 459–477. https://doi.org/10.1007/82_2014_409 (2015).
7. Houzet, L. & Jeang, K. T. Genome-wide screening using RNA interference to study host factors in viral replication and pathogenesis. Exp. Biol. Med. (Maywood) 236, 962–967. https://doi.org/10.1258/ebm.2010.010272 (2011).
8. Orr-Burks, N., Murray, J., Todd, K. V., Bakre, A. & Tripp, R. A. G-protein-coupled receptor and ion channel genes used by infuenza virus for replication. J. Virol. https://doi.org/10.1128/JVI.02410-20 (2021).
9. Gordon, D. E. et al. A SARS-CoV-2 protein interaction map reveals targets for drug repurposing. Nature 583, 459–468. https:// doi.org/10.1038/s41586-020-2286-9 (2020).
10. Perwitasari, O. et al. Targeting organic anion transporter 3 with probenecid as a novel anti-infuenza a virus strategy. Antimicrob. Agents Chemother. 57, 475–483. https://doi.org/10.1128/AAC.01532-12 (2013).
11. Nigam, S. K. et al. Te organic anion transporter (OAT) family: a systems biology perspective. Physiol. Rev. 95, 83–123. https:// doi.org/10.1152/physrev.00025.2013 (2015).
12. Burckhardt, G. Drug transport by organic anion transporters (OATs). Pharmacol. Ter. 136, 106–130. https://doi.org/10.1016/j. pharmthera.2012.07.010 (2012).
13. Burckhardt, B. C. & Burckhardt, G. Transport of organic anions across the basolateral membrane of proximal tubule cells. Rev. Physiol. Biochem. Pharmacol. 146, 95–158. https://doi.org/10.1007/s10254-002-0003-8 (2003).
14. Strilchuk, L., Fogacci, F. & Cicero, A. F. Safety and tolerability of available urate-lowering drugs: a critical review. Expert. Opin. Drug. Saf. 18, 261–271. https://doi.org/10.1080/14740338.2019.1594771 (2019).
15. Woodruf, A. COVID-19 follow up testing. J. Infect. 81, 647–679. https://doi.org/10.1016/j.jinf.2020.05.012 (2020).
16. Washington, N. L. et al. Emergence and rapid transmission of SARS-CoV-2 B.1.1.7 in the United States. Cell https://doi.org/10. 1016/j.cell.2021.03.052 (2021).
17. Driouich, J. S. et al. Favipiravir antiviral efcacy against SARS-CoV-2 in a hamster model. Nat. Commun. 12, 1735. https://doi. org/10.1038/s41467-021-21992-w (2021).
18. Bertzbach, L. D. et al. SARS-CoV-2 infection of Chinese hamsters (Cricetulus griseus) reproduces COVID-19 pneumonia in a well-established small animal model. Transbound. Emerg. Dis. https://doi.org/10.1111/tbed.13837 (2020).
19. Boras, B. et al. Discovery of a novel inhibitor of coronavirus 3CL protease as a clinical candidate for the potential treatment of COVID-19. BioRxiv https://doi.org/10.1101/2020.09.12.293498 (2020).
20. Good, S. S. et al. AT-527, a double prodrug of a guanosine nucleotide analog, is a potent inhibitor of SARS-CoV-2 in vitro and a promising oral antiviral for treatment of COVID-19. Antimicrob. Agents. Chemother. https://doi.org/10.1128/AAC.02479-20 (2021).
21. Sheahan, T. P. et al. An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice. Sci. Transl. Med. https://doi.org/10.1126/scitranslmed.abb5883 (2020).
22. Rennick, B. R. Renal excretion of drugs: tubular transport and metabolism. Annu. Rev. Pharmacol. 12, 141–156. https://doi.org/ 10.1146/annurev.pa.12.040172.001041 (1972).
23. Kelley, W. N. & Wyngaarden, J. B. Drug treatment of gout. Semin. Drug Treat. 1, 119–147 (1971).
24. Sahu, G., Sukumaran, S. & Bera, A. K. Pannexins form gap junctions with electrophysiological and pharmacological properties distinct from connexins. Sci. Rep. 4, 4955. https://doi.org/10.1038/srep04955 (2014).
25. Silverman, W., Locovei, S. & Dahl, G. Probenecid, a gout remedy, inhibits pannexin 1 channels. Am. J. Physiol. Cell Physiol. 295, C761-767. https://doi.org/10.1152/ajpcell.00227.2008 (2008).
26. Rosli, S. et al. Repurposing drugs targeting the P2X7 receptor to limit hyperinfammation and disease during infuenza virus infection. Br. J. Pharmacol. 176, 3834–3844. https://doi.org/10.1111/bph.14787 (2019). 7 Vol.:(0123456789) Scientifc Reports | (2021) 11:18085 | https://doi.org/10.1038/s41598-021-97658-w www.nature.com/scientificreports/
27. Sinha, S. et al. In vitro and in vivo identifcation of clinically approved drugs that modify ACE2 expression. Mol. Syst. Biol. 16, e9628. https://doi.org/10.15252/msb.20209628 (2020).
28. Sharma, K. et al. Metabolomics reveals signature of mitochondrial dysfunction in diabetic kidney disease. J. Am. Soc. Nephrol. 24, 1901–1912. https://doi.org/10.1681/ASN.2013020126 (2013).
29. Erdman, A. R. et al. Te human organic anion transporter 3 (OAT3; SLC22A8): genetic variation and functional genomics. Am. J. Physiol. Renal. Physiol. 290, F905-912. https://doi.org/10.1152/ajprenal.00272.2005 (2006).
30. Sato, M. et al. Involvement of uric acid transporters in alteration of serum uric acid level by angiotensin II receptor blockers. Pharm. Res. 25, 639–646. https://doi.org/10.1007/s11095-007-9401-6 (2008).
31. Imai, M. et al. Syrian hamsters as a small animal model for SARS-CoV-2 infection and countermeasure development. Proc. Natl. Acad. Sci. U S A 117, 16587–16595. https://doi.org/10.1073/pnas.2009799117 (2020).
32. Pizzi, M. Sampling variation of the ffy percent end-point, determined by the Reed-Muench (Behrens) method. Hum. Biol. 22, 151–190 (1950).
33. Selen, A., Amidon, G. L. & Welling, P. G. Pharmacokinetics of probenecid following oral doses to human volunteers. J. Pharm. Sci. 71, 1238–1242. https://doi.org/10.1002/jps.2600711114 (1982).
34. Javed, H., Meeran, M. F. N., Jha, N. K. & Ojha, S. Carvacrol, a plant metabolite targeting viral protease (M(pro)) and ACE2 in host cells can be a possible candidate for COVID-19. Front. Plant. Sci. 11, 601335. https://doi.org/10.3389/fpls.2020.601335 (2020).
Lược dịch: BS.CKII. LÊ XUÂN TÚY
PHÓ GIÁM ĐỐC CHUYÊN MÔN BV TÂM TRÍ
PHỤ TRÁCH CHUYÊN MÔN TẬP ĐOÀN TÂM TRÍ
Các tin khác
- One in 10 People Who Had Omicron Got Long COVID: Study ( 20:25 - 01/06/2023 )
- Physical Medicine Academy Issues Guidance on Long COVID Neurologic Symptoms ( 09:58 - 19/05/2023 )
- SARS-CoV-2 đi qua nhau thai và lây nhiễm não của hai trẻ sơ sinh: “Đây là trường hợp đầu tiên” ( 16:55 - 10/04/2023 )
- Breakthrough' Study: Diabetes Drug Helps Prevent Long COVID ( 08:55 - 15/03/2023 )
- BCG vaccine (thuốc chủng ngừa bệnh lao) & SARS-CoV 2 (covid-19) infection ( 10:08 - 27/10/2022 )
- Đại dịch COVID-19 đã kết thúc? ( 09:11 - 22/09/2022 )
- Dị hình giới tính ở COVID-19: Ý nghĩa tiềm năng về lâm sàng và sức khỏe cộng đồng ( 09:22 - 19/03/2022 )
- COVID-19 Update ( 21:00 - 06/03/2022 )
- Một người có thể tái mắc Covid-19 bao nhiêu lần ?? ( 20:25 - 06/03/2022 )
- T-cells from common colds can provide protection against COVID-19 - study ( 08:25 - 11/01/2022 )